SARS-CoV-2 Real-Time PCR Kiti
Kullanım Amacı
Bu dokümanda 2019 Yeni Koronavirüs’ün (SARS-CoV-2) real-time RT-PCR yoluyla solunum örneklerinden ve serumdan in vitro kalitatif tespiti anlatılmaktadır. SARS-CoV-2 primer ve prob setleri SARS-CoV-2’nin spesifik olarak tespit edilmesi için tasarlanmıştır.
Bu kit CDC’nin ve DSÖ’nün en son tespit yönlendirmelerini izlemektedir.
Ürünün Tanımı
DIAGNOVITAL® SARS-CoV-2, 2019 Wuhan Koronavirüs (SARS-CoV-2) için real-time RT-PCR tabanlı bir tespit sistemidir. SARS-CoV-2, mevsimsel akut solunum hastalıklarına yol açan yaygın insan koronavirüslerinden (229E, NL63, OC43, HKU1) genetik olarak farklı olduğu kabul edilen yeni bir tip insan koronavirüsüdür. Aynı zamanda, diğer iki yeni koronavirüs MERS-CoV ve SARS-CoV’dan da genetik olarak farklıdır.
DIAGNOVITAL® SARS-CoV-2, SARS-CoV-2’nin E geni, N geni ve RdRP geni olmak üzere 3 farklı ve yüksek derecede spesifik gen dizilerinin varlığını tespit eder. Örneğin SARS-CoV-2 pozitif olduğunu doğrulamak için her 3 testin de pozitif sonuç vermesi gerekir.
Ayrıca, enfeksiyöz olmayan bir pozitif kontrol ve bir ekstraksiyon negatif kontrolü (HEC) de kite dahildir. Pozitif kontrol, testlerin işlevselliğini ve toplam PCR performansını doğrulamak için kullanılır; ekstraksiyon negatif kontrolü ise SARS-CoV-2 testlerinden bağımsız olarak RNA izolasyonunun kalitesinin değerlendirilmesi içindir.
SARS-CoV-2’nin qPCR-tabanlı Tespiti
SARS-CoV-2’nin tespit edilmesinde ilk adım viral RNA’nın cDNA’ya dönüştürülmesidir. Daha sonra, SARS-CoV-2’ye özgü hedef diziler, floresan işaretli probların kullanılması sayesinde gerçek zamanlı olarak takip edilen bir amplifikasyon işleminde spesifik olarak çoğaltılır. Yeni amplifiye edilmiş (çoğaltılmış) DNA iplikçiklerine bağlanma olunca florofor (FAMTM) serbest kalır ve foresan sinyalinde bir artış gözlenir.
Koronavirüslerin özünde olan mutasyon oranı nedeniyle hedef dizide bu mutasyonların meydana gelmesi ve zaman içinde birikmesi mümkündür. Bu durum PCR-tabanlı tespit yaklaşımlarında yalancı pozitif sonuçlara yol açabilir. DIAGNOVITAL® SARS-CoV-2, değişime uğramış bir hedef dizinin neden olduğu yalancı pozitif sonuçları en aza indirmek için 3 farklı hedef dizi üzerinde 3 tespit testi gerçekleştirerek bu sorunun üzerine düşer.
Örnekler bir veya daha çok kez negatif çıkarsa başka tamamlayıcı testlerin yapılması gerekebilir. Testlerin bütünlüğünü kontrol etmek amacıyla SARS-CoV-2’nin orijinal hedef dizileri enfeksiyöz olmayan hedef pozitif kontrolleri (TPC) olarak kite dahil edilmiştir.
Pozitif sonuç alınan örnekler daima tamamlayıcı yöntemler ve ilave analizler ile bağımsız bir laboratuvar tarafından doğrulanmalıdır
Sağlanan Reaktifler

Gerekli Diğer Malzemeler
• Nükleik asit ekstraksiyonunda kullanılacak uygun araçlar ve cihazlar (bölüm 3.4’e bakın)
• FAMTM tespiti için donanıma sahip real-time PCR tespit sistemi
• Ayarlanabilir pipetler ve filtreli pipet uçları
• Potansiyel olarak enfeksiyöz örnekler ile çalışmaya uygun kişisel korunma gereçleri ve çalışma alanı
• Yüzey dezenfeksiyonu için maddeler: DNAZapTM (Life Technologies), DNA AwayTM (Fisher Scientific), RNAse AwayTM (Fisher Scientific), %10 çamaşır suyu (ticari olarak temin edilen %5,25 – 6 sodyum hipokloritin 1:10 seyreltilmesi) gibi
• Dilüsyon yapmak, master miksleri hazırlamak gibi işlemlerde kullanılacak nükleaz içermeyen tüpler, stripler ve plaklar
• PCR cihazına uygun nükleaz içermeyen tüpler, stripler ve plaklar
• Reaktiflerin ve örneklerin saklanması için uygun saklama koşulları (4°C, -20°C, -70°C)
Saklama Koşulları
• Tüm kit bileşenlerini -20°C’de saklayın. Tekrar tekrar dondurup çözmeyin.
• 2x qPCR master miksleri ışıktan uzak tutun; ışığa uzun süre maruz kalmaları floroforların performansına zarar verir.
• Kit bileşenleri nakliye sırasında zarar görmüşse Labormed ile iletişime geçin. Zarar görmüş ürünleri kullanmayın aksi halde performans kaybı meydana gelebilir.
• Kontaminasyon olmasını önlemek için reaktifleri ve örnekleri ayrı tutun.
• Belirtilen son kullanma tarihinden sonra kullanmayın.
Performans Özellikleri
Analitik hassasiyet
Analitik duyarlılık, DIAGNOVITAL SARS-CoV-2 Referans numunelerinin bir dilüsyon serisi kullanılarak analiz edildi. 300, 100, 30 ve 10 kopya / ml’lik nihai konsantrasyonları vermek üzere bir DIAGNOVITAL SARS-CoV-2 Referans numunelerinin bir seyreltme serisi hazırlanmıştır. Her seyreltme 24 kopya halinde test edilmiştir. Alt sınır PASW Statistics 18 programları tarafından yapılan probit analizi ile hesaplanmıştır. Her genotip / alt tip için, Saptama Sınırı (LoD) değerleri ve% 95 güven aralıkları Tablo 1’de özetlenmiştir.
Tablo 1: SARS-CoV-2qPCR Kiti – Saptama Sınırı (LoD) değerleri ve% 95 güven aralıkları

Kesinlik
Bu çalışmada kitin kesinliği, RTA Viral NA İzolasyon Kiti (Kat No: 09029) ve farklı örnek tipleri (orofaringeal ve nazofaringal sürüntüler, bronkoalveolar lavaj örnekleri) kullanılarak test içi, testler arası, gruplar arası için değerlendirildi. Her hedef gen ve farklı deneyler için 103 kopya / ml DİAGNOVİTAL
SARS-CoV-2 Referans numunelerinin 24 kopyası kullanıldı. Betimsel istatistikler IBM SPSS Statistics programı ile analiz edilmiştir. Ct değerleri ile ilişkili toplam hassasiyet deneyleri Tablo 2’de özetlenmiştir.
Tablo 2: SARS-CoV-2 hassas verilerinin genel tanımlayıcı istatistikleri.

Teşhis özgüllüğü
SARS-CoV-2 RNA negatif klinik örnekleri, DIAGNOVITAL SARS-CoV-2Real Time PCR Kitinin tanısal spesifisitesini belirlemek için analiz edildi. 40 SARS-CoV-2 RNA negatif klinik orofarengal swab örneği ve 40 SARS-CoV-2 RNA negatif klinik orofaringal swab örneği ve 30 bronkoalveolar lavaj örneği kullanıldı. 100 SARS-CoV-2 negatif klinik örneğinin hiçbiri SARS-CoV-2 için pozitif test sonucu vermedi. DIAGNOVITAL SARS-CoV-2 Gerçek Zamanlı PCR Kitinin tanısal özgüllüğü% 100’dür. Tüm İnsan Ekstraksiyon Kontrolü (HEC) testleri pozitif sonuç vermiştir.
Çapraz reaktivite
Bir analizin özgüllüğünü incelemek için potansiyel çapraz reaktif belirteçler için çapraz reaktivite çalışmaları yapılmalıdır. Bu çalışmada testin özgüllüğü test edilerek değerlendirildi. Bu çalışma, 9 referans organizma ve 11 pozitif klinik örnek kullanılarak gerçekleştirildi.
SARS-CoV-2 Gerçek Zamanlı PCR Kiti, aşağıdaki tablo 3’te verilen diğer potansiyel çapraz reaktif ajanlar ile çapraz reaktivite göstermemektedir:



Başlangıç Öncesi Uyarılar ve Önlemler
Biyogüvenlik
• Klinik örnekler ile çalışırken uygun kişisel korunma giysileri giyin (örn: laboratuvar önlüğü, pudrasız tek kullanımlık eldiven, göz ve yüz koruyucu).
• Hasta örnekleri seviye 2 veya üzeri biyogüvenlik yönergelerine uygun, onaylı sınıf II biyolojik
• güvenlik kabinlerinde çalışılmalıdır.
• Daha fazla bilgi için aşağıdaki bağlantıları ziyaret edin:
• SARS-CoV-2 örnekleri ile çalışma: https://www.cdc.gov/coronavirus/SARS-CoV-2/guidelines-clinical-specimens.html
• Mikrobiyoloji laboratuvarında güvenlik: http://www.cdc.gov/biosafety/publications/
• Bu kit yalnızca eğitimli profesyonel personel tarafından kullanılabilir.
Örnekler
Test için uygun örnekler şunlardır:
Nazofarengiyal / orofarengiyal aspiratlar veya yıkamalar, nazofarengiyal / orofarengiyal svaplar, bronkoalveolar lavaj, trake aspiratları ve balgam gibi solunum sistemi örnekleri,
Svap örnekleri yalnızca sentetik uçlu (polyester veya Dacron® gibi), plastik saplı svap çubukları ile
alınmalıdır. Kalsiyum alginatlı veya pamuk uçlu, tahta saplı svap çubukları uygun değildir.
Örneklerin Ele Alınması ve Saklanması
• Örnekler toplandıktan sonra 4°C’de 72 saate kadar saklanabilir.
• Ekstraksiyon işleminde bir gecikme olacaksa örnekleri -70°C veya daha düşük sıcaklıkta saklayın.
• Ekstrakte edilmiş nükleik asitler -70°C veya daha düşük sıcaklıkta saklanmalıdır. Aşağıdaki koşullarda örnekleri kullanmayın:
• 2-4°C arasında (≤ 4 gün) ya da -70°C veya daha düşük sıcaklıkta saklanmamışsa,
• Üzerinde yeterli bilgi yoksa ve bilgisi belgelenmemişse,
• Bu amaç için kullanıma uygun değilse (yukarıda uygun örnek materyallerine bakın),
• Örneğin hacmi yeterli değilse
Örneklerin Hazırlanması / Nükleik Asit Ekstraksiyonu
• RT-PCR testlerinin performansı örnek olarak kullanılan RNA kalıbının miktarına ve kalitesine son derece bağlıdır. Örnekleri test etmeden önce RNA ekstraksiyonu prosedürlerinizi verim ve saflık bakımından mutlaka kontrol edin ve doğrulayın.
• DIAGNOVITAL Tespit Kitleri ile birlikte başarılı bir şekilde çalışan nükleik asit ekstraksiyon sistemleri şunlardır:
• RTA Viral NA Isolation Kit from Swabs, bioMérieux NucliSens® systems, QIAamp® Viral RNA Mini Kit, QIAamp® MinElute Virus Spin Kit veya RNeasy® Mini Kit (QIAGEN), EZ1 DSP Virus Kit (QIAGEN), Roche MagNA Pure Compact RNA Isolation Kit, Roche MagNA Pure Compact Nucleic Acid Isolation Kit ve Roche MagNA Pure 96 DNA ve Viral NA Small Volume Kit ve Invitrogen ChargeSwitch® Total RNA Cell Kit.
• Artan örnekleri ve ekstrakte edilen nükleik asitleri -70°C’de muhafaza edin.
• Yalnızca o gün çalışacağınız kadar örnek ekstraktını çözün.
• Ekstraktları birden çok kez dondurup çözmeyin; tekrar tekrar dondurup çözme RNA kalitesine zarar verir.
• Hasta örneklerini tipine bağlı olarak doğrudan kullanmak mümkündür. Ancak bunun için önceden bir liz adımı yapılması ve reaksiyonu inhibe etmeden kullanılabilecek örnek miktarının titrasyon ile ayarlanması gerekebilir. Bu çalışma prosedürü doğrulanmamıştır ve bu yüzden izole edilmiş RNA ile çalışılması önerilir.

Reaksiyonun Kurulması
1. Çalışmaya başlamadan önce gerekli tüm araçların ve cihazların çalışma için uygun olduğunu, kalibre edildiğini ve çalışır durumda olduğunu kontrol edin.
2. Cihazları ve çalışma alanını dekontamine edin ve deneyin uzamaması ve tekrarlanabilir olması için gerekli her şeyi önceden hazır edin.
3. PCR cihazını açın ve reaksiyon kurulumunu yapmadan önce cihazı programlayın.
4. DIAGNOVITAL® SARS-CoV-2‘nin tüm bileşenlerini buz üzerinde çözün, hafifçe ve iyice karıştırarak içeriğinin homojen bir şekilde dağılmasını sağlayın. Kısa bir spin yaparak sıvıyı tüpün dibinde toplayın.
5. İlk testlerde en uygun konsantrasyon aralığını belirlemek için RNA örneğiniz ile bir dilüsyon serisi hazırlayın. Bir reaksiyon için önerilen örnek hacmi 4-5 µl’dir.
6. Master miks plağını hazırlayın:
a. Reaktiflerinizde kontaminasyon varsa bunu tespit etmek için kontrol reaksiyonlarını örnek materyalinde (NTC) değil, daima nüklez içermeyen dH2O içinde hazırlayın.
b. RNA izolatınızın kalitesini değerlendirmek için daima çalışmanıza bir ekstraksiyon negatif kontrolü (HEC) dahil edin.
c. Kitteki hedef pozitif kontrolü (TPC) kullanırken bir reaksiyon için 5 µl kullanın ve nükleaz içermeyen dH2O ile 20 µl’ye tamamlayın.
d. Her örnek için en az iki kopya çalışılması önerilir.
e. Çalışmayı planladığınız tüm reaksiyonlara yetecek kadar master miks hazırlayın. Pipetleme hatalarını dikkate alarak 2 reaksiyon fazladan hazırlamanız önerilir.
f. Hazırladığınız master miksi stiplere veya plaklara paylaştırın. Aşağıda Şekil 1’de örnek bir kurulum gösterilmektedir.

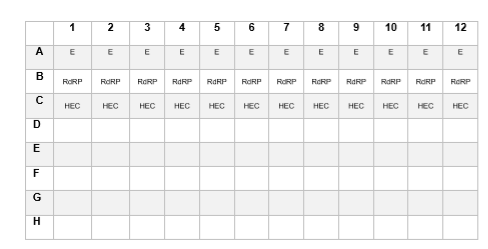
Şekil 1: Master mikslerin ve test mikslerinin dağıtımına örnek bir pipetleme planı
a. Önce negatif reaksiyonları hazırlayın ve pozitif örnekleri uygulamadan önce negatif örneklerin üzerini örtün. Ancak negatif kontrolleri hazırladıktan ve üzerlerini örttükten sonra potansiyel pozitif örnekleri ve hedef pozitif kontrolünü çalışma alanına sokun.
b. Örnekleri master miks plağına ekleyin. Örnek bir kurulum aşağıda Şekil 2’de verilmektedir.
c. Kurulan reaksiyonları PCR cihazına aktarana kadar buz üzerinde tutun.
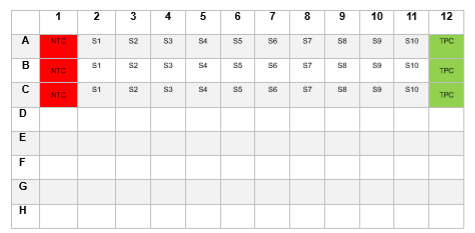
Şekil 2: Örneklerin eklenmesine örnek bir pipetleme planı. Plağın alt yarısı aynı planda dizilmiş kopyalar için kullanılabilir.
Reaksiyonları PCR cihazına yerleştirin ve aşağıdaki talimatlara göre çalışmayı yapın:

8. Cihazın çalışması tamamlandıktan sonra reaksiyon tüplerini açmayın ve kontaminasyon meydana gelmesini önleyin. Atıkları yerel talimatlara ve yönetmeliklere uygun olarak bertaraf edin. Otoklavlama yapmayın, aksi halde laboratuvar amplikonlar ile kontamine olabilir.

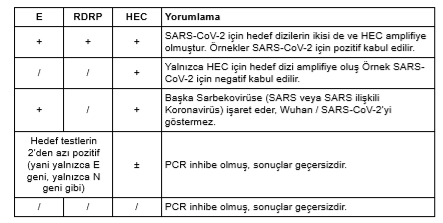
Analiz ve Sorun Giderme
Örnek Sonuç

• Hiçbir çalışmada dH2O kontrolleri (NTC) bir pozitif Ct vermemelidir. Vermişse reaksiyon örnek RNA / DNA ile kontamine olmuş demektir. Cihazları ve çalışma alanını dekontamine edin ve testleri tekrar edin.
• Bir örneğin SARS-CoV-2 pozitif olarak kabul edilmesi için her 2 test de (E / RdRP) pozitif Ct değerleri vermelidir. Ekstraksiyon negatif kontrolü (HEC) amplifiye olmamış olsa da örnek pozitif kabul edilmelidir.
• Bir örneğin SARS-CoV negatif olarak kabul edilmesi için 2 testin (E / RdRP) hiçbiri pozitif Ct değeri vermemelidir. Bu örnekler için uygun miktarda örnek materyalinin bulunduğunu doğrulamak için ekstraksiyon negatif kontrolü (HEC) pozitif Ct değeri (< 35 döngü) vermelidir.
• RNA izolatı bulunan tüm reaksiyonlar HEC testi için pozitif Ct değer, vermelidir. Ct değerleri < 35 döngü olmalıdır. Ekstraksiyon negatif kontrolünün amplifiye olmaması RNA ekstraksiyonunda sorun olduğuna veya RNAz kontaminasyonu nedeniyle RNA izolatında kayıp olduğuna işaret eder. örnek yeterli değildir, sonuçlar yorumlanamaz.
• SARS-CoV-2 için TPC (hedef pozitif kontrolü) kullanılırken her 2 test için de pozitif Ct görülmelidir. TPC için Ct değeri < 35 döngü olmalıdır. Ct değerleri beklenen değer ile uyuşmuyorsa veya tüm testler pozitif çıkmamışsa PCR işlemi şüpheli olur. Reaksiyon kurulumunu ve PCR cihazının ayarlarını kontrol edin ve reaksiyonları yeniden çalışın. TPC’nin tekrar tekrar dondurulup çözülmesi kalitesini bozabilir ve geç Ct değerlerine yol açabilir.
• Hiçbir test için amplifikasyon sinyali görülmezse PCR inhibe olmuş demektir. Reaksiyon kurulumunu ve cihazın ayarlarını kontrol edin ve gerekirse RNA ekstraksiyonunu yeniden yapın. Bu durumda sonuçlar geçersizdir ve yorumlanamaz.
• Hedef testlerin ikisi de pozitif değilse (yani yalnızca E geni, yalnızca N geni gibi) sonuçlar tutarlı değildir. Reaksiyon kurulumunu ve cihazın ayarlarını kontrol edin ve gerekirse RNA ekstraksiyonunu yeniden yapın. Bu durumda sonuçlar geçersizdir ve yorumlanamaz.
Sınırlamalar
•^Güvenilir sonuçlar almanız için bu kullanma kılavuzunda verilen talimatlara uyun. Reaksiyon kurulumunda veya PCR döngü protokolünde değişiklik yapmak çalışmaların başarısız olmasına neden olabilir.
• İzole edilmiş RNA’da örnek matriksine bağlı olarak inhibitörler bulunabilir ve ters transkripsiyon ve/veya PCR amplifikasyonu gerçekleşmeyebilir. Bu durumda başka bir örnek tipinin veya izolasyon yönteminin kullanılması fayda sağlayabilir.
• Hedef dizide meydana gelmiş spontane mutasyonlar hedef dizinin tespit edilememesine yol açabilir.
• Sonuçlar daima o örnek ile alınmış diğer tüm veriler ile birlikte değerlendirilmelidir. Sonuçların yorumlanması bu tip çalışmalar için eğitimli ve deneyimli profesyonel personel tarafından yapılmalıdır.
Ticari Markalar
DIAGNOVITAL®, NucliSens® (bioMérieux), QIAamp®, RNeasy® (QIAGEN), ChargeSwitch® (Invitrogen), ROXTM, FAMTM (Life Technologies), DNAZapTM , DNA AwayTM, RNAse AwayTM ticari markalardır ve yasalarca koruma altındadır.

Adres : Izzetpasa Mahallesi Gurun Caddesi No:1 D:1 Sisli / Istanbul / Turkey
Telefon: +90 212 343 72 05
E-mail: labor@labormed.biz
Web: http://labormed.biz/








